通過(guò)對(duì)新的藥品注冊(cè)管理辦法涉及的各項(xiàng)條款內(nèi)容進(jìn)行梳理,江左君認(rèn)為,新修訂的《藥品注冊(cè)管理辦法》是對(duì)近年來(lái)我國(guó)藥品審評(píng)審批制度改革措施和經(jīng)驗(yàn)的重要總結(jié),涵蓋了上市許可持有人制度、臨床試驗(yàn)?zāi)驹S可、附條件批準(zhǔn)、優(yōu)先審評(píng)審批、特別審批程序等多項(xiàng)重大制度,對(duì)醫(yī)藥行業(yè)創(chuàng)新、完善全生命周期監(jiān)管起到了重要的作用,綜合體現(xiàn)了落實(shí)“四個(gè)最嚴(yán)”要求、落實(shí)“放管服”要求以及落實(shí)藥品審評(píng)審批改革的精神,將對(duì)我國(guó)醫(yī)藥行業(yè)健康發(fā)展起到重要的促進(jìn)作用。
江左君認(rèn)為,新修訂的《藥品注冊(cè)管理辦法》對(duì)行業(yè)影響的特點(diǎn)主要體現(xiàn)在以下方面:
特點(diǎn)一:全面鼓勵(lì)藥品創(chuàng)新
縱觀《辦法》全文,江左君認(rèn)為,國(guó)家全面鼓勵(lì)藥品創(chuàng)新。第一章第七條、第二章第十三條以至通過(guò)單獨(dú)章節(jié)第四章藥品加快上市注冊(cè)程序,來(lái)充分體現(xiàn)對(duì)新藥創(chuàng)制的鼓勵(lì)。其中明確了突破性治療藥物程序、附條件批準(zhǔn)程序、優(yōu)先審評(píng)審批程序、特別審批程序這四個(gè)加快審批通道,對(duì)防治公共衛(wèi)生事件、危重疾病、無(wú)有效治療手段疾病的藥品以及臨床急需藥品做出了特殊的制度安排。
圖表1 藥品加快上市注冊(cè)程序的具體情況

資料來(lái)源:南方醫(yī)藥經(jīng)濟(jì)研究所整理
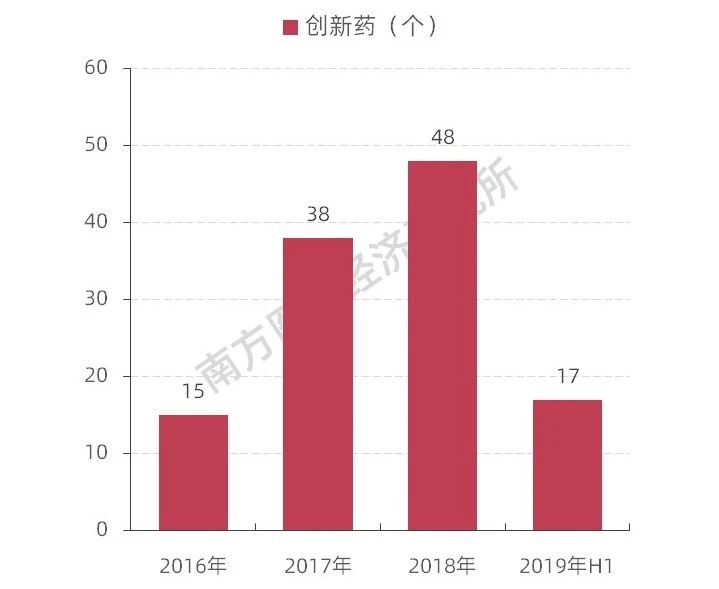
江左君強(qiáng)調(diào),通過(guò)幾年的修訂調(diào)研論證,通過(guò)藥品加快上市注冊(cè)程序直接鼓勵(lì)并推動(dòng)創(chuàng)新藥上市,簡(jiǎn)政放權(quán)實(shí)施了多項(xiàng)默示許可以及備案管理的模式,優(yōu)化了審評(píng)審批的各項(xiàng)環(huán)節(jié),這將藥品審評(píng)審批改革的成果以法規(guī)的形式予以確立,這對(duì)鼓勵(lì)藥品創(chuàng)新形成了更為穩(wěn)定的政策環(huán)境,中國(guó)新藥研發(fā)正進(jìn)入歷史最佳階段。南方醫(yī)藥經(jīng)濟(jì)研究所(以下簡(jiǎn)稱“南方所”)數(shù)據(jù)整理顯示,2018年我國(guó)創(chuàng)新藥的申請(qǐng)就比2016年增加了75%。2018年獲批新藥48個(gè),其中抗癌新藥就有18個(gè),比2017年增長(zhǎng)了157%??梢?jiàn)鼓勵(lì)新藥創(chuàng)制的政策足以調(diào)動(dòng)新藥研發(fā)的熱情。
圖表2 2016年至2019上半年我國(guó)創(chuàng)新藥獲批情況
資料來(lái)源:南方醫(yī)藥經(jīng)濟(jì)研究所整理
江左君點(diǎn)評(píng)
一是創(chuàng)新藥將成為市場(chǎng)新寵,能夠最大限度地滿足廣大人民群眾用到最新最好的藥品。
二是在未來(lái),預(yù)期市場(chǎng)上將保持藥品研發(fā)的熱情,在藥品創(chuàng)新機(jī)制下加快藥品研發(fā)領(lǐng)域的分工細(xì)化,在不同環(huán)節(jié)演變不同的研發(fā)業(yè)態(tài)。在醫(yī)藥研發(fā)領(lǐng)域?qū)⑿纬梢慌弋a(chǎn)品質(zhì)量、提供一體化服務(wù)的綜合型企業(yè)與高技術(shù)壁壘細(xì)分領(lǐng)域的醫(yī)藥研發(fā)頭部企業(yè)。
三是醫(yī)藥生產(chǎn)企業(yè)形成兩極分化,具備研發(fā)能力的醫(yī)藥生產(chǎn)企業(yè)在新藥政策的鼓勵(lì)下將進(jìn)一步發(fā)展成為創(chuàng)新型企業(yè),而另一大部分不具備藥品研發(fā)的企業(yè)將更多的成為加工型生產(chǎn)企業(yè)。
四是促進(jìn)我國(guó)醫(yī)藥研發(fā)領(lǐng)域在藥品價(jià)值鏈中向歐美醫(yī)藥行業(yè)價(jià)值鏈靠攏,醫(yī)藥創(chuàng)新的政策環(huán)境與氛圍逐步形成,參與世界競(jìng)爭(zhēng)的瓶頸逐步突破;擁有創(chuàng)新藥的醫(yī)藥研發(fā)企業(yè)將被藥品生產(chǎn)企業(yè)競(jìng)相追逐,新藥批文轉(zhuǎn)讓交易甚至并購(gòu)行為將增多。
五是創(chuàng)新藥的醫(yī)藥企業(yè)將成為醫(yī)藥領(lǐng)域的主要投資標(biāo)的物,國(guó)產(chǎn)創(chuàng)新藥將進(jìn)入回報(bào)期。
特點(diǎn)二:滿足藥品臨床急需
江左君認(rèn)為,《辦法》第四章藥品加快上市注冊(cè)程序中,也著重強(qiáng)調(diào)了以臨床為導(dǎo)向,以滿足藥品臨床急需的優(yōu)先審評(píng)審批程序來(lái)刺激臨床急需、必需的藥品研發(fā),體現(xiàn)了以人民為中心的研發(fā)創(chuàng)新思路,杜絕了為研發(fā)而研發(fā)的怪異思維。
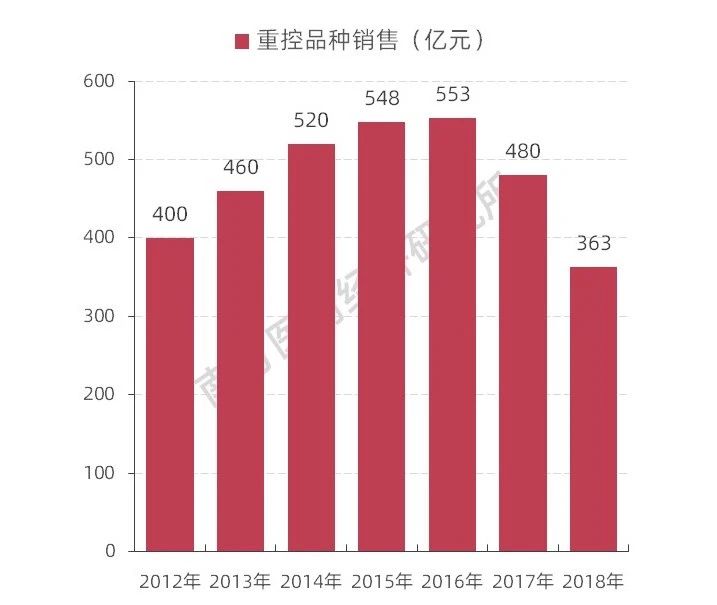
從市場(chǎng)情況看,隨著近年來(lái)國(guó)家衛(wèi)生、醫(yī)保、藥監(jiān)“三醫(yī)聯(lián)動(dòng)”機(jī)制有機(jī)運(yùn)轉(zhuǎn)以來(lái),極大程度地讓沒(méi)有臨床價(jià)值或價(jià)值“性價(jià)比”不高的藥品限制使用甚至逐步退出臨床應(yīng)用指南,以“騰籠換鳥(niǎo)”方式讓更多有臨床價(jià)值的老藥、好藥、新藥甚至是必需藥品進(jìn)入臨床使用。南方所數(shù)據(jù)監(jiān)測(cè)發(fā)現(xiàn),從2019版國(guó)家醫(yī)保目錄將衛(wèi)健委發(fā)布的20個(gè)重點(diǎn)監(jiān)控品種剔除等政策合力的效果來(lái)看,“非治療性藥物”品種的使用已經(jīng)降幅度50%以上,“非治療性藥物”將逐步讓位于有臨床價(jià)值藥品。預(yù)計(jì)未來(lái)有臨床價(jià)值藥品、臨床必需藥品和創(chuàng)新藥品在市場(chǎng)上將獲利于更多臨床使用。
圖表3 20個(gè)重點(diǎn)監(jiān)控品種銷(xiāo)售額情況
資料來(lái)源:南方醫(yī)藥經(jīng)濟(jì)研究所整理
江左君點(diǎn)評(píng)
一是引導(dǎo)研發(fā)企業(yè)摒棄原有“為研發(fā)而研發(fā)”的不良思維,真正重視以臨床為導(dǎo)向的新藥研發(fā)思維。
二是加大研發(fā)企業(yè)對(duì)臨床急需、必需藥品的研發(fā)熱情和研發(fā)力度,尤其在腫瘤用藥領(lǐng)域,兒童用藥新劑型開(kāi)發(fā)領(lǐng)域、罕見(jiàn)病領(lǐng)域、短缺藥品、重大傳染病用藥、疾病防控急需疫苗和創(chuàng)新疫苗等較受關(guān)注,但應(yīng)引導(dǎo)避免盲目研發(fā)、扎堆研發(fā)的情況出現(xiàn)。
三是市場(chǎng)上將大幅壓縮“非治療性藥物”品種的市場(chǎng)空間,其中部分品種將逐步退出市場(chǎng)。
特點(diǎn)三:注重創(chuàng)仿并舉
江左君認(rèn)為,《辦法》在鼓勵(lì)創(chuàng)新的同時(shí),重視仿制藥的發(fā)展。其中第一章第四條、第七條明確提出積極發(fā)展仿制藥,并在后面的第二章第十八條、第三章第三十五條、第四十七條等均有涉及。江左君認(rèn)為,在《辦法》修訂過(guò)程中,國(guó)家藥品監(jiān)督管理局已經(jīng)開(kāi)展仿制藥質(zhì)量和療效一致性評(píng)價(jià)工作,并開(kāi)展建立仿制藥質(zhì)量和療效一致性評(píng)價(jià)的化學(xué)藥品目錄集,并在中成藥、化藥和生物制品中均建立了新藥、改良型新藥和仿制藥的分類(lèi)體系,為仿制藥以及改良型新藥的上市奠定了基礎(chǔ)。
南方所監(jiān)測(cè)數(shù)據(jù)顯示,我國(guó)醫(yī)院用藥監(jiān)測(cè)體系中,仿制藥仍然占據(jù)主導(dǎo)地位,隨著仿制藥一致性評(píng)價(jià)工作的開(kāi)展,截至2019年10月31日,有236個(gè)基藥品種通過(guò)或視同通過(guò)一致性評(píng)價(jià),其中289目錄中的產(chǎn)品為81個(gè),通過(guò)占比為28.0%,而在全國(guó)重點(diǎn)藥品招標(biāo)及各省招標(biāo)中,過(guò)仿制藥一致性評(píng)價(jià)品種直接參與原研藥品的競(jìng)爭(zhēng),替代性很高。另在“三醫(yī)聯(lián)動(dòng)”機(jī)制下,因“4+7”帶量采購(gòu)試點(diǎn)擴(kuò)圍,將50%~70%的市場(chǎng)采購(gòu)量給予通過(guò)仿制藥一致性評(píng)價(jià)的中選藥品,醫(yī)藥企業(yè)參與一致性評(píng)價(jià)的積極性顯著提高。
江左君點(diǎn)評(píng)
一是加快仿制藥一致性評(píng)價(jià)工作進(jìn)度,隨著“三醫(yī)聯(lián)動(dòng)”政策的逐步配套和落地,醫(yī)藥企業(yè)參與仿制藥一致性評(píng)價(jià)的動(dòng)力將提高。
二是終端市場(chǎng)競(jìng)爭(zhēng)中,過(guò)仿制藥一致性評(píng)價(jià)的品種競(jìng)爭(zhēng)優(yōu)勢(shì)明顯,將取代或蠶食原研藥市場(chǎng),逐步實(shí)現(xiàn)國(guó)產(chǎn)替代。
三是醫(yī)藥企業(yè)將更加關(guān)注改良型新藥的二次開(kāi)發(fā)和市場(chǎng)開(kāi)發(fā)工作,該類(lèi)品種的高性價(jià)比將受到醫(yī)藥企業(yè)的重視。
特點(diǎn)四:明確主體責(zé)任
江左君認(rèn)為,《辦法》從兩個(gè)方面明確了主體責(zé)任,明確規(guī)定了各職能部門(mén)職責(zé)的同時(shí),也明確了上市許可持有人的主體責(zé)任。一方面,《辦法》明確并細(xì)化了藥品注冊(cè)管理各部門(mén)和各環(huán)節(jié)的職責(zé),確保藥品注冊(cè)受理、審評(píng)、檢查和檢驗(yàn)等各環(huán)節(jié)的有效銜接,提高藥品注冊(cè)效率和預(yù)期性。
圖表4 國(guó)家藥監(jiān)局各部門(mén)以及省藥監(jiān)局的職責(zé)分工

資料來(lái)源:南方醫(yī)藥經(jīng)濟(jì)研究所整理
另一方面,在確定各監(jiān)管部門(mén)職責(zé)的同時(shí),注冊(cè)管理辦法全面引入了藥品上市許可持有人,在近29處條款內(nèi)容中提出了藥品上市許可持有人,規(guī)定了其主體責(zé)任。藥品上市許可持有人依法對(duì)藥品研制、生產(chǎn)、經(jīng)營(yíng)、使用全過(guò)程中藥品的安全性、有效性和質(zhì)量可控性負(fù)責(zé)。在研制環(huán)節(jié),要遵循藥品非臨床研究質(zhì)量管理規(guī)范、藥物臨床試驗(yàn)質(zhì)量管理規(guī)范;在生產(chǎn)環(huán)節(jié),要建立健全藥品生產(chǎn)質(zhì)量管理體系,保證生產(chǎn)全過(guò)程持續(xù)符合法定要求;流通環(huán)節(jié),持有人應(yīng)當(dāng)建立并實(shí)施追溯制度,保證藥品可追溯;在藥品上市后管理中要建立年度報(bào)告制度,強(qiáng)化藥品全過(guò)程信息要求。
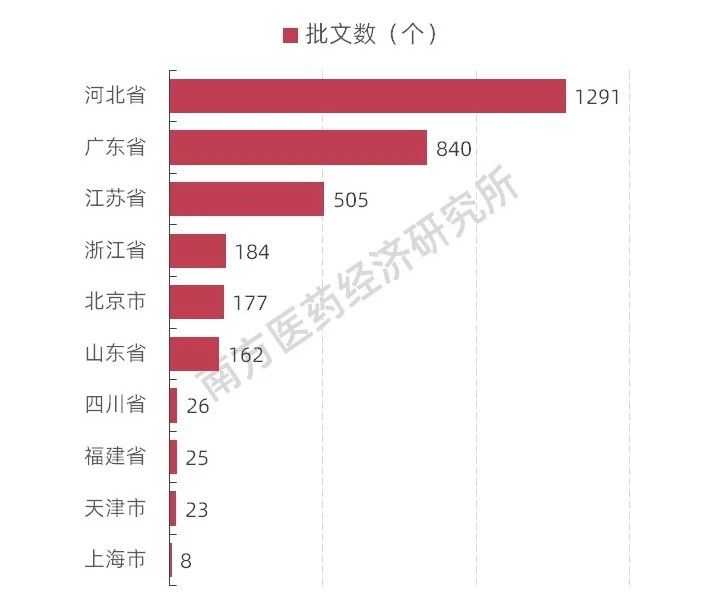
南方所監(jiān)測(cè)數(shù)據(jù)顯示,截至2019年9月1日,從10個(gè)上市許可持有人制度試點(diǎn)省份的試點(diǎn)情況來(lái)看,共有3241個(gè)藥品生產(chǎn)批文取得成為上市許可人,其中河北省生產(chǎn)批文號(hào)總數(shù)排名第一,成為上市許可持有人的生產(chǎn)批文號(hào)超過(guò)1000個(gè),廣東、江蘇緊跟其后。隨著試點(diǎn)結(jié)束,全面實(shí)施上市許可人制度,也就意味著,所有藥品生產(chǎn)批文將自動(dòng)成為上市許可持有人,這些許可人或?yàn)槠髽I(yè)或?yàn)閭€(gè)人,或?yàn)樯a(chǎn)企業(yè)或?yàn)檠邪l(fā)企業(yè)。
圖表5 上市許可持有人制度試點(diǎn)省份獲批許可持有人數(shù)量
資料來(lái)源:南方醫(yī)藥經(jīng)濟(jì)研究所整理
江左君點(diǎn)評(píng)
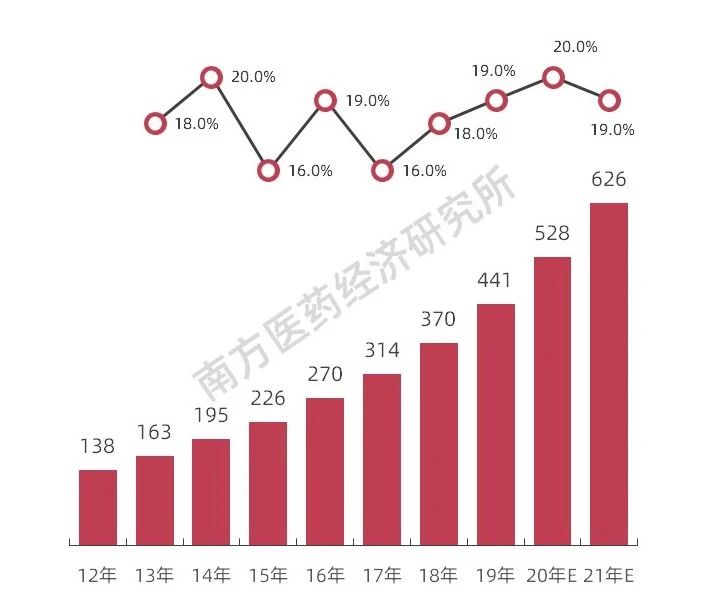
一是藥品上市許可持有人制度的實(shí)施,將進(jìn)一步促進(jìn)合同生產(chǎn)業(yè)務(wù)/合同生產(chǎn)研發(fā)業(yè)務(wù)(CMO/CDMO)的高速發(fā)展,南方所預(yù)計(jì),2021年我國(guó)CMO/CDMO的市場(chǎng)規(guī)模將達(dá)到626億元。
圖表6 我國(guó)CMO/CDMO市場(chǎng)規(guī)模及發(fā)展趨勢(shì)
資料來(lái)源:南方醫(yī)藥經(jīng)濟(jì)研究所整理
二是醫(yī)藥研發(fā)企業(yè)成為上市許可持有人后,可根據(jù)自身狀況并未一定按原有模式將產(chǎn)品轉(zhuǎn)讓,可通過(guò)代理模式直接參與藥品生產(chǎn)和銷(xiāo)售環(huán)節(jié),保持產(chǎn)品的所有權(quán),獲取更大的利益回報(bào),在一定程度上重組或改變產(chǎn)品營(yíng)銷(xiāo)模式。
三是醫(yī)藥企業(yè)集團(tuán)內(nèi)部操作,可將集團(tuán)內(nèi)的藥品生產(chǎn)批文進(jìn)行優(yōu)化調(diào)整,這將有利于醫(yī)藥企業(yè)集團(tuán)內(nèi)部資源優(yōu)化整合,甚至改變生產(chǎn)營(yíng)銷(xiāo)架構(gòu)體系。
四是預(yù)計(jì)未來(lái),藥品批文交易和技術(shù)轉(zhuǎn)讓市場(chǎng)能夠成為熱門(mén)領(lǐng)域,引導(dǎo)行業(yè)產(chǎn)品重組優(yōu)化。
五是由于上市許可持有人目前仍有部分政策還沒(méi)有落地或理順,導(dǎo)致以個(gè)人成為上市許可持有人的比重較低,且在全國(guó)近20萬(wàn)個(gè)藥品生產(chǎn)批文中,所占比重仍然不到2%,具備較大的觀望心理。
特點(diǎn)五:科學(xué)引導(dǎo)研發(fā)
江左君認(rèn)為,《辦法》在體現(xiàn)科學(xué)引導(dǎo)研發(fā)方面進(jìn)行了條款內(nèi)容上的強(qiáng)調(diào),一方面在第四章第三節(jié)優(yōu)先審評(píng)審批程序的第六十八條明確表示, 具有明顯臨床價(jià)值的藥品,可以申請(qǐng)適用優(yōu)先審評(píng)審批程序。另一方面在第三章(藥品上市注冊(cè))、第五章(藥品上市后變更和再注冊(cè))第二節(jié)(藥品再注冊(cè))的第八十二條、第八十三條和第八十四條對(duì)藥品注冊(cè)和再注冊(cè)進(jìn)行了詳細(xì)描述。結(jié)合2015年5月27日,國(guó)家藥監(jiān)局發(fā)布的《國(guó)家食品藥品監(jiān)督管理總局發(fā)布藥品、醫(yī)療器械產(chǎn)品注冊(cè)收費(fèi)標(biāo)準(zhǔn)和實(shí)施細(xì)則》說(shuō)明,新藥注冊(cè)費(fèi)用(臨床試驗(yàn)約20萬(wàn)元,生產(chǎn)上市約43萬(wàn)元)、仿制藥注冊(cè)費(fèi)(無(wú)需臨床試驗(yàn)的生產(chǎn)上市約18萬(wàn)元,需臨床試驗(yàn)的生產(chǎn)上市約32萬(wàn)元)、再注冊(cè)費(fèi)用(進(jìn)口品種約23萬(wàn)元,國(guó)產(chǎn)品種約2萬(wàn)元),其收費(fèi)標(biāo)準(zhǔn)均比之前大幅度提高,進(jìn)一步與國(guó)際接軌。說(shuō)明國(guó)家在藥品注冊(cè)環(huán)節(jié)開(kāi)始注重引導(dǎo)行業(yè)科學(xué)合理研發(fā),盡量避免低水平重復(fù),甚至高水平建設(shè)的情況發(fā)生。
南方所在2016年通過(guò)醫(yī)院終端監(jiān)測(cè)系統(tǒng)[HDM]和零售終端監(jiān)測(cè)系統(tǒng)[RDM]全品種批文比對(duì)分析顯示:共監(jiān)測(cè)到在銷(xiāo)藥品品種11946個(gè),占總藥品品種數(shù)量的71.37%;共監(jiān)測(cè)到在銷(xiāo)批準(zhǔn)文號(hào)69220個(gè),占批準(zhǔn)文號(hào)總量(162483件)的42.60%,可以看出批準(zhǔn)文號(hào)的總體利用率較低,也同時(shí)意味著有近一半的藥品批文處于“睡眠”狀態(tài),沒(méi)有實(shí)質(zhì)有經(jīng)濟(jì)利益,對(duì)這些品種的批文再注冊(cè)費(fèi)用也會(huì)損耗生產(chǎn)企業(yè)的利潤(rùn)來(lái)源。
圖表7 我國(guó)藥品批文利用率表
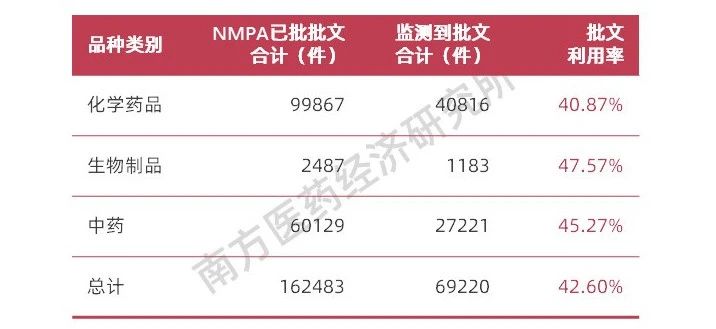
資料來(lái)源:南方醫(yī)藥經(jīng)濟(jì)研究所整理
江左君點(diǎn)評(píng)
一是注冊(cè)費(fèi)和再注冊(cè)費(fèi)用的合理提升,可促進(jìn)醫(yī)藥生產(chǎn)企業(yè)科學(xué)、合理地開(kāi)展研發(fā)工作。
二是通過(guò)藥品生產(chǎn)批文的合理優(yōu)化,醫(yī)藥生產(chǎn)企業(yè)將會(huì)淘汰一部分沒(méi)有市場(chǎng)價(jià)值的藥品批文,或?qū)⑦@些藥品批文轉(zhuǎn)讓交易。
特點(diǎn)六:落實(shí)“四個(gè)最嚴(yán)”
江左君認(rèn)為,《辦法》按照全生命周期監(jiān)管理念設(shè)置了相應(yīng)環(huán)節(jié),并將藥品上市后變更和再注冊(cè)整合為一章,并細(xì)化相關(guān)要求。在第四節(jié)第四十六條中增加藥物研究機(jī)構(gòu)和藥物臨床試驗(yàn)機(jī)構(gòu)監(jiān)督檢查相關(guān)內(nèi)容,對(duì)藥品研制注冊(cè)和生產(chǎn)質(zhì)量監(jiān)管進(jìn)行銜接,保證藥品注冊(cè)管理貫穿藥品的全生命周期。
同時(shí)《辦法》還豐富了監(jiān)管手段。在第三章第三十九條中規(guī)定將藥品生產(chǎn)工藝納入藥品品種檔案,進(jìn)行動(dòng)態(tài)更新,為上市后監(jiān)管提供了重要支持。并在第八章第一百零八條中規(guī)定建立藥品安全信用管理制度,由核查中心負(fù)責(zé)建立藥物非臨床安全性評(píng)價(jià)研究機(jī)構(gòu)、藥物臨床試驗(yàn)機(jī)構(gòu)藥品安全信用檔案。另外,《辦法》還在第八章第一百零九條規(guī)定公開(kāi)審評(píng)結(jié)論和依據(jù),通過(guò)社會(huì)共治,強(qiáng)化監(jiān)管效果。
南方所分析數(shù)據(jù)顯示,從2015年起,國(guó)家藥品監(jiān)督管理部門(mén)已經(jīng)開(kāi)始針對(duì)藥物臨床試驗(yàn)機(jī)構(gòu)開(kāi)展了多次自查核查工作,這項(xiàng)工作啟動(dòng)四個(gè)月后就有19.54%的注冊(cè)申請(qǐng)主動(dòng)撤回,有力地整肅臨床試驗(yàn)數(shù)據(jù)造假,凈化研發(fā)生態(tài)環(huán)境。新的辦法明確臨床試驗(yàn)機(jī)構(gòu)的監(jiān)督檢查規(guī)定,將進(jìn)一步強(qiáng)化對(duì)臨床試驗(yàn)數(shù)據(jù)造假的打擊力度,強(qiáng)調(diào)了臨床試驗(yàn)機(jī)構(gòu)的安全信用檔案管理,從制度上充分防范臨床試驗(yàn)造假。
江左君點(diǎn)評(píng)
一是規(guī)范了藥品創(chuàng)新環(huán)境,有力的防范臨床數(shù)據(jù)造假的情況,監(jiān)管部門(mén)能夠?qū)⒂行У膶徳u(píng)審批資源集中高效應(yīng)用在臨床實(shí)用的藥品批準(zhǔn),有利于促進(jìn)藥品創(chuàng)新高質(zhì)量發(fā)展。
二是醫(yī)藥研發(fā)領(lǐng)域?qū)⑦M(jìn)一步整合凈化,一批不符合資質(zhì)不具備實(shí)事求是、科學(xué)嚴(yán)謹(jǐn)?shù)难邪l(fā)企業(yè)將被淘汰出局。
三是全生命周期藥品注冊(cè)監(jiān)管體系基本確立,藥品上市許可持有人充分承壓。藥品上市持有許可人是藥品全生命周期中藥品安全和有效責(zé)任承擔(dān)者,是藥品全生命周期所有參與資源的支配者,處于主導(dǎo)地位。新辦法確立了藥品全生命周期藥品注冊(cè)監(jiān)管體系,增加了監(jiān)管手段,這也意味著藥品上市許可持有人承擔(dān)的責(zé)任更加明確,受到的監(jiān)管更加嚴(yán)格。
特點(diǎn)七:優(yōu)化審評(píng)審批流程
江左君認(rèn)為,《辦法》采取了多種方式,優(yōu)化了審評(píng)審批流程與藥品注冊(cè)管理制度,做出了多項(xiàng)重大變革,充分體現(xiàn)“放管服”的各項(xiàng)要求。其中在第二章第三節(jié)中增加了關(guān)聯(lián)審評(píng)審批制度的相關(guān)內(nèi)容,對(duì)實(shí)施的具體細(xì)節(jié)進(jìn)行了明確規(guī)定。在第三章第二十三條中規(guī)定藥物臨床試驗(yàn)申請(qǐng)審批采取默示許可制度,必須在自受理之日起六十日內(nèi)決定是否同意開(kāi)展。在第三章第二十四條中顯示,生物等效性試驗(yàn)已由原來(lái)的許可制改為備案制;第五章對(duì)藥品變更實(shí)行分類(lèi)管理,按照變更程度由省級(jí)藥品監(jiān)督管理部門(mén)實(shí)施備案管理或企業(yè)年度報(bào)告管理。依據(jù)產(chǎn)品創(chuàng)新程度和風(fēng)險(xiǎn)特點(diǎn),實(shí)行基于風(fēng)險(xiǎn)的審評(píng)、核查和檢驗(yàn)?zāi)J健?/div>
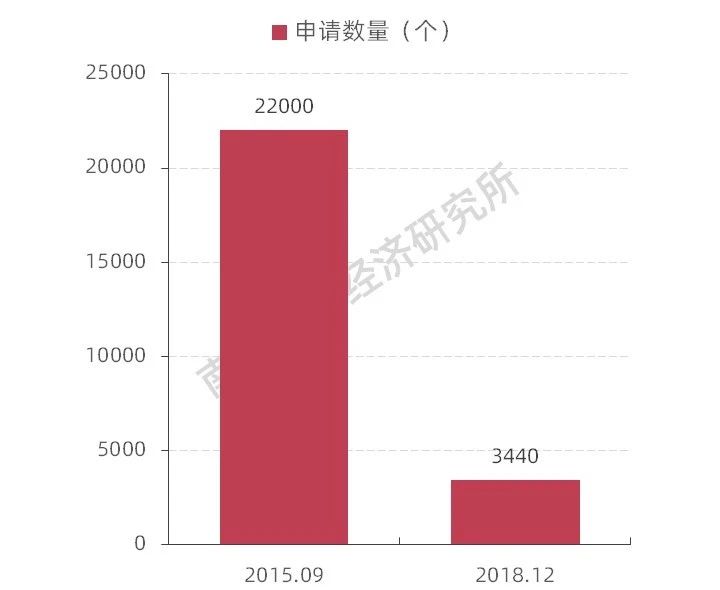
南方所分析數(shù)據(jù)顯示,在《辦法》出臺(tái)之前,國(guó)家藥品監(jiān)管部門(mén)已經(jīng)針對(duì)藥品審評(píng)審批制度改革采取了一系列的措施,優(yōu)化審批流程,提高審批效率。2018年的審評(píng)報(bào)告顯示,國(guó)家藥品監(jiān)管部門(mén)完成審評(píng)審批的注冊(cè)申請(qǐng)共9796件,平均審批時(shí)限為12.3個(gè)工作日,遠(yuǎn)小于法定的20日行政審批時(shí)限,排隊(duì)等待審評(píng)審批的注冊(cè)申請(qǐng)已由2015年9月高峰時(shí)的近22000件降至3440件。這意味著一個(gè)新藥的上市將面臨更短暫的排隊(duì)時(shí)間和更低的成本,這將為新藥創(chuàng)新形成強(qiáng)大的助力,預(yù)計(jì)我國(guó)新藥創(chuàng)新將邁上一個(gè)巨大的臺(tái)階。
圖表8 我國(guó)藥品注冊(cè)申請(qǐng)數(shù)量變化

資料來(lái)源:南方醫(yī)藥經(jīng)濟(jì)研究所整理
江左君點(diǎn)評(píng)
一是國(guó)家局加快審評(píng)審批速度,提高審評(píng)審批效率,放管服效果顯現(xiàn),將有利于醫(yī)藥研發(fā)領(lǐng)域的新藥創(chuàng)新積極性,尤其是一些臨床必需的藥物。
二是仿制藥市場(chǎng)的競(jìng)爭(zhēng)程度將進(jìn)一步提高。隨著生物等效性試驗(yàn)改備案制的確立,新批準(zhǔn)上市以及通過(guò)仿制藥質(zhì)量和療效一致性評(píng)價(jià)的化學(xué)藥品目錄集的推出,開(kāi)發(fā)高質(zhì)量仿制藥的難度將進(jìn)一步降低,更多高質(zhì)量仿制藥將進(jìn)入市場(chǎng),預(yù)計(jì)競(jìng)爭(zhēng)度將會(huì)加劇。
三是藥包材輔料產(chǎn)業(yè)朝高質(zhì)量發(fā)展方向提速。關(guān)聯(lián)審評(píng)審批制減少了審評(píng)審批事項(xiàng),降低輔料和包材企業(yè)負(fù)擔(dān),增加制劑企業(yè)的選擇權(quán),同時(shí)使行業(yè)更加重視原輔包和制劑質(zhì)量之間的聯(lián)系。因此預(yù)計(jì)藥包材輔料產(chǎn)業(yè)將會(huì)在提高產(chǎn)品質(zhì)量的方向發(fā)展。
特點(diǎn)八:重視中藥傳承發(fā)展
江左君認(rèn)為,中醫(yī)藥是我國(guó)特有之瑰寶,在此次新冠疫情的防治過(guò)程中,中醫(yī)藥發(fā)揮了重要的臨床作用?!掇k法》在第一章第四條,中藥類(lèi)別中增加了古典名方復(fù)方制劑和同名同方藥這兩種類(lèi)別,形成了具備中藥特點(diǎn)的注冊(cè)分類(lèi)體系,在第二章第十九條中要求申請(qǐng)人以臨床價(jià)值和資源評(píng)估為導(dǎo)向進(jìn)行注冊(cè)申請(qǐng)。此次新辦法明確提出古典名方復(fù)方制劑和同名同方藥兩大分類(lèi),是在國(guó)家通過(guò)《中醫(yī)藥法》之后中藥的傳承與發(fā)展的重大制度配套和變革。
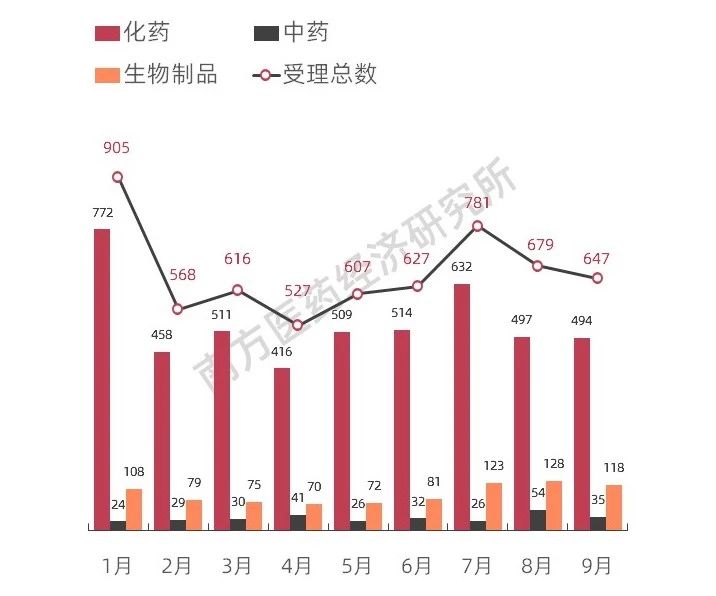
南方所監(jiān)測(cè)數(shù)據(jù)顯示,在中藥審批端口,根據(jù)2019年前三季度CDE受理藥品注冊(cè)情況來(lái)看,中成藥的獲批數(shù)量呈現(xiàn)緩慢上升的狀態(tài),預(yù)計(jì)這一情況在接下來(lái)的幾年將得到扭轉(zhuǎn)。
圖表9 2019年前三季度CDE受理藥品注冊(cè)情況

資料來(lái)源:南方醫(yī)藥經(jīng)濟(jì)研究所整理
而從終端使用配套政策看,目前2019版醫(yī)保藥品目錄中含1321個(gè)中成藥,占比49.98%,數(shù)量已經(jīng)比2000版醫(yī)保目錄多了近一半,占比也提高了近8%。在多種政策合力之下,中成藥產(chǎn)業(yè)將迎來(lái)新一輪以臨床價(jià)值為導(dǎo)向的高質(zhì)量發(fā)展模式。
江左君點(diǎn)評(píng)
一是對(duì)促進(jìn)中藥傳承創(chuàng)新提供了重要的契機(jī)?!吨嗅t(yī)藥法》第三十條明確指出來(lái)源于古代經(jīng)典名方的中藥復(fù)方制劑,在申請(qǐng)藥品批準(zhǔn)文號(hào)時(shí),可以僅提供非臨床安全性研究資料。結(jié)合2018年國(guó)家藥監(jiān)局出臺(tái)的“古代經(jīng)典名方中藥復(fù)方制劑簡(jiǎn)化注冊(cè)審批管理規(guī)定”,預(yù)計(jì)將針對(duì)經(jīng)典名方采用更為靈活以及符合中醫(yī)藥發(fā)展特點(diǎn)的審評(píng)審批規(guī)定,為中藥方劑瑰寶的傳承與創(chuàng)新帶來(lái)促進(jìn)作用。
二是推動(dòng)中成藥產(chǎn)業(yè)科學(xué)健康發(fā)展。新的分類(lèi)更加科學(xué)合理,體現(xiàn)了中藥產(chǎn)業(yè)的特色和特點(diǎn),臨床價(jià)值和資源評(píng)估的相關(guān)要求也可能是中成藥的重要發(fā)展方向,將促進(jìn)圍繞古典名方復(fù)方制劑和同名同方的研發(fā)需求。
三是中藥資源可持續(xù)利用、經(jīng)濟(jì)與生態(tài)協(xié)調(diào)發(fā)展將成為中藥加工企業(yè)重要的戰(zhàn)略考量。新辦法明確指出申請(qǐng)人應(yīng)當(dāng)進(jìn)行臨床價(jià)值和資源評(píng)估,突出以臨床價(jià)值為導(dǎo)向,促進(jìn)資源可持續(xù)利用。參考國(guó)家藥品監(jiān)督管理部門(mén)在2017年發(fā)布的中藥資源評(píng)估技術(shù)指導(dǎo)原則,中成藥申請(qǐng)人將充分考慮實(shí)現(xiàn)中藥資源可持續(xù)利用,保障中藥資源的穩(wěn)定供給,這也將重構(gòu)目前的中藥材市場(chǎng),優(yōu)質(zhì)優(yōu)價(jià)將成為中藥的重要發(fā)展方向。